RPAはヌクレオソームを形成するDNAへのHSF1の結合を介助する
平成30年10月25日掲載
大学院医学系研究科 准教授 藤本充章(医化学講座)
【利用施設】RI実験施設
私たちの研究室では、熱ショック応答の制御因子である熱ショック転写因子(HSF1)の研究を行っている。HSF1は、主に熱ショックタンパク質(HSP)を誘導することで細胞内のプロテオスタシス容量を調節している。生体内ではその一部が構成的にDNAに結合して転写調節を担うことで、老化や老化と関連するタンパク質ミスフォールディング病の進行を抑制する一方、がんの発症や進展を促進することが知られている。しかしながら、HSF1がヌクレオソームDNAへ結合する機構につては不明であった。私たちは、高等動物細胞でのHSF1による転写制御機構を明らかにするため、プロテオミクス解析によりHSF1結合タンパク質を新たに多数同定した[1]。その中で、DNA複製や修復に関与するRPA(Replication Protein A)群はHSF1と複合体を形成することでヌクレオソーム構造をとるDNAへの結合を促し、構成的な転写とプロテオスタシスの調節に寄与していることを明らかにした。この機構によって、ストレス時には速やかにHSPの転写を促進できる環境を整えている。さらに、このHSF1-RPA複合体は、マウスでのメラノーマ腫瘍形成に必要であることも分った[1]。
RI実験施設では、in vitroでのタンパク質-DNA相互作用の測定に用いるゲルシフトアッセイ法(EMSA;electrophoretic mobility shift assay)を用いてHSF1のDNA結合活性を調べた。具体的には、HSF1が結合するDNA配列をラジオアイソトープ(RI)である[γ-32P]ATPで標識し、それと野生型HSF1(hHSF1-HA)あるいはRPAと相互作用しない変異体HSF1(hHSF1-E85D-HA他)とを反応させてポリアクリルアミドゲルに電気泳動して分析を行い、一群の変異体が野生型と同様の結合活性を持つことを示した(図1)[1]。さらに同じ方法を用いて、野生型HSF1にRPAを添加してもDNAへの親和性(Kd=約2.50 nM)に変化を及ぼさないことも示した(図2)[1]。このRIを利用したゲルシフトアッセイ法の感度と特異性は、RIを用いない方法を凌駕しており、私たちの一連の転写機構解明に向けた研究に常に貢献している[2-4]。
[1] M. Fujimoto, et al. Mol. Cell 48, 182-194, 2012
[2] K. Tan, et al. Nat. Commun. 6, 6580, 2015
[3] R. Takii, et al. Mol. Cell. Biol. 35, 11-25, 2015
[4] M. Fujimoto, et al. Nat. Commun. 2017, in press
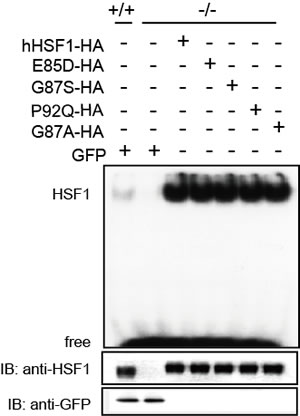
図1 野生型および変異型HSF1のin vitroでのDNA結合活性
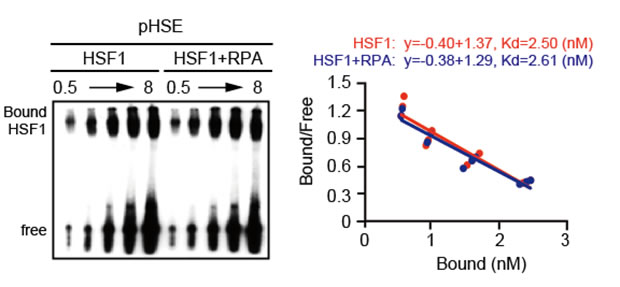
図2 RPA添加によるHSF1のDNA結合活性の変化












